
编者按:
杂交水稻的研究与应用为我国粮食安全、农民增收和种业发展做出了巨大贡献。如今,杂交水稻作为我国的原创技术也走出国门正在为世界水稻生产做出新的贡献。杂交稻的培育和推广已成为我国农业科研的名片,这是以袁隆平、朱英国、谢华安等为代表的老一辈科学家集体创造的成就。近年来,我国科学家在水稻杂种优势的分子机制研究和新技术开发等方面同样取得了令人瞩目的进展。饮水思源,薪火相传。本文就水稻雄性不育分子机制的最新研究进展以及杂种优势利用的新技术进行综述,以期为广大农业科研工作者提供参考,共同推进主要粮食作物杂种优势利用技术研究,为我国和全球粮食安全保驾护航。
杂种优势是指杂交后代在产量、品质、适应性、抗逆性、生长势和繁殖力等多个性状超越亲本的一种生物学现象,在自然界普遍存在。19世纪60年代,达尔文首先在玉米中描述了杂种优势,20世纪20年代玉米杂种优势在美国开始利用,使其成为第一个商业化的杂交种子作物。100年后的1966年,袁隆平先生的“水稻的雄性不孕性”科研论文发表,文章报道了他在田间发现的水稻雄性不育现象, 并提出三系配套开展水稻杂种优势利用的设想。1973 年,光敏核不育水稻在湖北的发现使得两系杂交稻培育成功。半个世纪以来,我国杂交稻的研究和应用技术一直处于世界领先地位,目前杂交稻的常年种植面积已稳居水稻总面积的50%以上,大幅度地提高了水稻产量,有力地保障了中国人民的饭碗。

图片来源于网络
杂种优势的规模化应用首先必须解决杂交种子的生产问题,而对于自花授粉的水稻而言,雄性不育的利用是亲本间杂交的先决条件,其次,必须能够规模化维持和繁殖雄性不育植物,最后,植物雄性不育必须在F1代中得到恢复,进而收获具有高产潜力的种子。尽管有人工去雄和化学去雄的方法来创制雄性不育,但自然的雄性不育无疑是杂交种子规模化生产的理想选择。从基因型组成角度上划分,目前生产中利用的水稻雄性不育包括核质互作不育(即细胞质雄性不育:cytoplasmic male sterility,CMS)和环境敏感型核不育系(environmental genic male sterility,EGMS)两种类型。
一、核质互作雄性不育及其恢复基因
1、核质互作的遗传机制
CMS系不仅其细胞质的线粒体有不育基因S,而且其细胞核里有纯合的不育基因(rfrf),二者同时存在赋予了CMS的雄性不育,其遗传组成为S(rfrf),不能产生正常的花粉,但可作为杂交母本。保持系N(rfrf)与不育系杂交所产生的F1仍能保持雄性不育,而CMS与恢复系S(RfRf)或N(RfRf)杂交,所产生的F1都是可育的。F1植株自交产生F2,在农业生产上可以广泛应用。
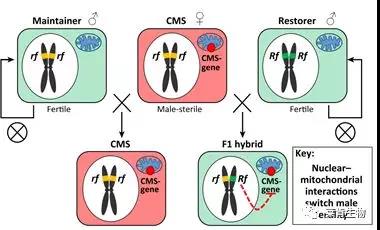
引自:Yu-Jin Kim & Dabing Zhang,2018,Trends Plant Sci.
2、CMS的分子机制
植物线粒体为半自主细胞器,它有自己的基因组,其编码的蛋白质对于三羧酸循环和ATP合成等正常功能的行使至关重要。绒毡层是花药壁的最内层,为小孢子的发育提供营养并参与其释放过程。通过转录组和蛋白组的遗传分析发现,线粒体基因组通过非同源重组和位点特异性重组,产生新的开放阅读框(open reading frame, orf),转录形成新的大小为10-35KDa的跨膜嵌合蛋白,这些蛋白异性地在绒毡层表达并与核编码的定位于线粒体的COX11蛋白相互作用,导致花药绒毡层细胞过早的启动细胞程序性死亡,从而造成雄性不育。在生产上广泛应用的水稻 CMS系主要包括野败型、包台型和红莲型等,其各自的CMS基因分别为WA352c, orf79和orfH79。
研究表明,产生新的线粒体基因是导致的CMS的主要原因。在植物进化过程中,这种新CMS基因的产生,可能促进异交结实并提高适合度,而且是赋予表型变化和生物多样性的基因组创新的一个重要来源。为阐明线粒体基因在结构和功能上的起源和演化机制,2017年,华南农业大学的刘耀光院士团队通过分析野生和栽培水稻中与WA352c相关的11个线粒体基因组重组体结构,推断这些结构是通过野生稻线粒体基因组中保守的线粒体序列之间的多次重排,再加上亚化学计量的移位序列变异而产生的。研究人员在这些结构中确定了两个具有表达活性、但无功能性的原基因(Protogene),通过序列变异演变为功能性CMS基因。因此,提出了“多次重组-原基因形成-功能化”的CMS基因演化模型。
3、育性恢复的分子机制
育性恢复基因Rf是恢复系的核基因,其编码的蛋白质定位于线粒体,能够抑制CMS基因的功能。目前已从9种作物中克隆到14个Rf基因,其中一半的Rf编码含有三角状五肽重复区结构域(pentatricopeptide repeat,PPR)的蛋白。研究发现,恢复基因与不育基因通过不同层次的调控机制发生相互作用。
首先,在转录后水平,Rf基因产物通过编辑、拼接、多聚腺苷酸化或剪切等方式影响CMS基因的转录。例如在包台不育系中,RF1A能够结合ATP6-orf79多顺反子转录本的间隔区并发生剪切,RF1B能够促进ATP6-orf79转录本的快速降解。类似地,野败不育系的Rf4和包台不育系的Rf1b能够降低WA352c 的mRNA的转录水平。在红莲不育系中,RF5(也称RF1A)和RF6在富含甘氨酸蛋白GRP162和己糖激酶OsHXK6的协助下剪切atp6-orfH79。
其次,育性的恢复机制也可以通过翻译或翻译后水平抑制CMS基因的表达而实现。例如Rf3对野败不育系的育性恢复不影响WA352c的mRNA水平,但抑制其蛋白的积累。2013年,刘耀光院士团队研究发现,在花药花粉母细胞期的绒毡层特异积累的WA352蛋白通过与COX11的互作,干扰其消除活性氧的功能,导致花药绒毡层线粒体的活性氧爆发和细胞色素c释放到细胞浆,提前启动PCD控制的绒毡层降解,从而产生花粉败育,而恢复基因Rf3通过抑制WA352蛋白的积累而恢复育性。

引自: Tang H, et al. 2017, Cell Research
武汉大学的朱英国院士团队对红莲型不育系的分子机制开展了系统研究。有趣的是,来自红莲型不育系的Rf5 和 Rf6 均能使包台型不育系的育性恢复,表明在驯化之前,针对不同类型的不育系,其育性的恢复具有一定的保守性。而且,同时含有Rf5 和 Rf6恢复基因比含有单个恢复基因的恢复系对红莲型不育系的恢复性更加稳定。此外,在高温胁迫条件下,Rf6的恢复性优于Rf5,说明二者的恢复机制也存在差异。
然而,在大多数情况下,Rf基因的恢复功能只对特定的不育系有效。鉴于核质互作协同进化模式的复杂性,三系杂交育种需要持续地挖掘和利用含有隐性Rf基因的CMS系及其对应的含有显性Rf等位基因的恢复系。
二、环境敏感型细胞核不育基因
EGMS是由细胞核基因突变引起的,在一定的温度、光照或湿度条件下可以发生育性转变。在农业生产中,EGMS 既可以作为不育系进行杂交制种,又可以作为保持系自交繁种,使杂交水稻的育种从三系法发展为两系法,大大简化了制种流程,降低了生产成本。EGMS不用考虑杂交父本有无恢复基因的问题,增加了水稻配种范围,有利于杂种优势的利用。在我国,两系杂交稻种植面积占到杂交稻面积的30%,而且其产量较三系杂交稻高出5-10%。因此,阐明EGMS的分子机制并挖掘更多的EGMS种质资源对于水稻的杂种优势利用意义重大。
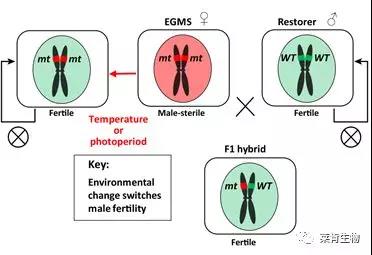
引自:Yu-Jin Kim & Dabing Zhang,2018,Trends Plant Sci.
1、EGMS的遗传调控
农垦58S是一个自然光敏核不育 (photoperiod-sensitive genic male sterility, PGMS) 突变体,在长日照高温条件下表现出完全不育。华中农业大学张启发院士团队从1987年开始水稻光敏不育基因的研究,于上世纪九十年代确定了农垦58S的光敏不育特性由pms1和pms3两个位点控制,经过近二十年的艰苦努力,2016年的研究发现,农垦58S的pms1是不完全显性基因,编码一个长非编码RNA (lncRNA),LDMAR(long-day-specific male-fertility-associated RNA)。pms1的转录本PMS1T能够被microRNA2118识别并介导剪切,形成一串21nt的小RNA,也称为phasiRNA。农垦58S与可育品种在pms1剪切位点下游的24bp处存在一个SNP位点,导致了农垦58S在长日照下能产生更多的phasiRNA,使其自身启动子区的甲基化水平升高,在长日照条件下转录水平降低,导致雄性不育。Pms3基因编码一个含有1236个碱基的lncRNA,促进长日照条件下的花粉发育。Pms3的SNP突变能够增加siRNA介导的其启动子区域的甲基化水平,降低在长日照条件下的转录水平。2014 年,华南农业大学庄楚雄教授和中国科学院曹晓风院士团队克隆了控制温敏不育的基因tms5,并发现 tms5 基因是控制我国温敏不育系的主要基因。TMS5 编码一个短的核糖核酸酶 RNase ZS1,在花药发育过程中该酶能够水解泛素60S-核糖核蛋白UbL40的mRNA。TMS5 突变后,在高温条件下,UbL40的mRNA 在花药中大量积累改变了泛素的动态平衡,进而导致不可溶的泛素化蛋白增加,诱发花粉母细胞的液泡化,最终导致了花粉败育。2017年,上海交通大学张大兵教授团队克隆了一个新的水稻温敏雄性不育基因TMS10,tms10突变体高温不育,低温可育,育性转换临界点温度为22-24℃。细胞学分析发现,TMS10编码一个亮氨酸受体激酶,高温条件下TMS10激酶活性在水稻花药绒毡层的降解过程中起重要作用。

引自: Y. et al. 2016, PNAS
此外,张大兵团队还系统研究了碳饥饿基因的不育机制。研究发现,CSA (CARBON STARVED ANTHER) 编码一个R2R3型的MYB转录因子,能够直接调节花药中单糖转运蛋白基因MST8(MONOSACCHARIDE TRANSPORTER 8)的转录。csa 突变体属于短日光敏核不育系,在长日照条件下可育,而在短日照条件下花药中糖分含量显著降低,导致雄性不育。将粳稻 JP69 作为恢复系与csa突变体杂交,F1代表现出明显的杂种优势,表明 csa 突变体在农业生产中具有实际意义。进一步研究发现,油菜素内酯信号因子 OsBZR1 可以直接结合到CSA的启动子上,从而促进其表达,使花药和种子中的糖分含量显著提高。这些研究证明,温度、光照时间等环境因素可能通过表观遗传方式参与植物育性调控。
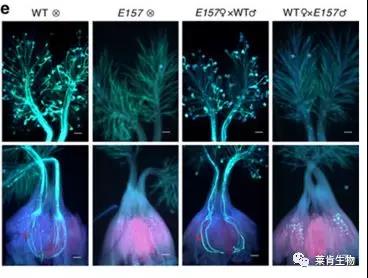
引自:Xue Z et al. 2018,Nature Commun.
2、湿敏雄性不育
当前,两系杂交稻主要利用光/温敏雄性不育系,然而这种EGMS不育系育性的控制需要严格的温度或光照条件,生产应用的范围有限。2018年,中国科学院漆小泉研究组发现了一种新型的水稻雄性不育系,该不育系的育性只受扬花期环境湿度的影响,可在夏季干旱少雨的地区配制杂种,从而突破目前水稻杂种优势利用的地域限制。研究发现,水稻中的三萜合酶OsOSC12/OsPTS1能够催化产生一种二环三萜化合物“禾谷绒毡醇”。缺失该酶功能的水稻植株所产生的花粉粒,其花粉包被中棕榈酸和亚麻酸的含量明显降低,并且完全缺少硬脂酸,花粉粒得不到有效保护而迅速失水而不育。这种突变体在湿度低于60%的环境中表现为不育,而在湿度高于80%的环境中则表现为完全可育。湿敏雄性不育(HGMS)相关调控机制在禾本科作物中普遍存在,对作物两系杂交育种和杂种优势利用具有重要意义。
三、杂种优势利用的新技术
1、转基因技术与杂种优势利用
在水稻两系法杂交制种过程中杂种纯度是影响种子质量的重要问题之一,例如遇到气温波动不育系自交结实种子。若不能有效地清除假杂种,将降低种子的质量、造成大田生产的产量损失。耐除草剂转基因技术可以有效地提高杂交水稻的制种纯度,即将外源耐除草剂基因转移到恢复系的品种中,经过自交选育出纯合耐除草剂基因的新型恢复系。用这样的恢复系配制杂交种,在杂种(F1)秧龄期施用一次除草剂不仅可以防除杂草,更重要的是除去假杂种,从而提高杂交种的产量和质量,该方法对于非选择性的除草剂尤为适用。黄大年等首次报道了该技术在提高两系杂交稻制种纯度中的应用。两系杂交早稻“香125s/Bar68”高产栽培的研究结果表明使用除草剂Basta后的纯度达99.98%,供试组合各项经济性状稳定,生长整齐。
引自:Chang Z et al. 2016,PNAS
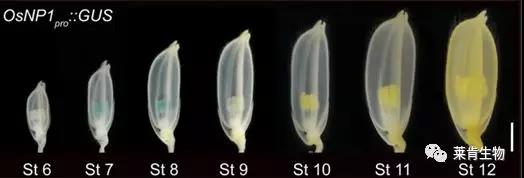
相对于核质互作雄性不育系而言,隐性细胞核雄性不育基因在作物中广泛存在,然而难以用普通的方法保持其不育性。由美国先锋公司研制的杂交种子生产技术(seed production technology,SPT)采用转基因方法成功地解决了细胞核隐性雄性不育的保持问题。具体而言,在雄性核不育系(rr)中同时转入紧密连锁的3个基因:(1)育性恢复基因R如Ms45,该基因能够使受体植株rr产生可育的花粉;(2)花粉致死基因F如zm-aa1,该基因编码的α-淀粉酶使得花粉发育因缺少能量而受阻;(3)种子筛选标记基因S如DsRed2,该基因编码的红色荧光蛋白在种子的糊粉层中表达。由于该保持系只能产生一种可育的雄配子类型r,因为R-F-S型雄配子由于含有F基因而不能存活,所以用rr作母本与该保持系杂交可以直接生产不育系,且不含转基因成分。该技术巧妙地将转基因技术和传统的杂交育种方法相结合,使杂种优势资源利用率大大提高,从而解决了常规杂交育种过程中资源利用率低、育种周期长等技术瓶颈,目前已在玉米雄性不育制种中得到应用。2016年,北京大学邓兴旺院士领衔的科研团队利用水稻中控制雄性不育的核基因OsNP1(Oryza sativa No Pollen 1)成功创制了水稻的SPT应用系统,该新型不育系的开发,被袁隆平先生称为“第三代杂交育种技术(G3育种技术)”,该技术兼具三系法的稳定性和两系法配组灵活性的优点,再加上杂交种属于非转基因而不需要经过复杂的转基因生物安全性评价试验,在转基因水稻商业化面临重重阻力的中国或许前景可期。
2、基因组编辑技术调控作物育性
近年来,随着基因组编辑技术的兴起以及雄性不育分子调控机制研究的深入,基因组编辑技术已应用于雄性不育系的创制。2016年,庄楚雄团队利用CRISPR/Cas9技术敲除水稻TMS5基因创制无转基因成分的温敏不育系(TGMS),研究人员仅用1年时间就获得了11个不同籼、粳亚种质、可用于杂交育种新的TGMS,可见该技术在缩短育种年限、挖掘杂种优势潜力等方面具有显著优势。同年,张大兵团队利用CRISPR/Cas9技术突变csa基因实现了籼稻种质的光敏育性的转变。2017年,中国科学院的高彩霞团队利用该技术敲除玉米中TMS5的同源基因ZmTMS5,结果显示,T1代转化体在32℃表现为雄性不育,而在24℃育性恢复,表明TMS5基因调控温敏不育性状具有保守性。同年,张大兵团队利用基因组编辑技术和传统的杂交转育方法分别在粳稻和籼稻中获得tms10纯合突变体,所有不育系均表现出高温不育,低温可育的表型,表明TMS10在粳稻和籼稻中功能保守,可用其开发新的温敏不育系材料。因此,基因组编辑技术在作物育性控制和杂种优势利用领域具有广阔的应用前景。

引自:Zhou, H. et al. 2016. Sci. Rep
四、小结
当前水稻雄性不育与育性恢复或转变的分子机制已初露端倪,然而距离全面解析其遗传调控机制并精确、高效操控水稻育性以及杂种优势的充分利用仍有很长的路要走。随着分子遗传学、生物信息学、合成生物学的发展,特别是以转基因、基因组编辑、细胞融合为代表的新兴生物技术的进步,包括水稻在内的主要作物的杂种优势利用必将开启新的华章。
主要参考文献:
Chang Z et al. (2016) Construction of a male sterility system for hybrid rice breeding and seed production using a nuclear male sterility gene. Proc Natl Acad Sci U S A. 6;113(49):14145-14150
Fan, Y. et al. (2016) PMS1T, producing phased small-interfering RNAs, regulates photoperiod sensitive male sterility in rice. Proc. Natl. Acad. Sci. U. S. A. 113, 15144–15149
Huang, W.C. et al. (2015) Pentatricopeptide-repeat family protein RF6 functions with hexokinase 6 to rescue rice cytoplasmic male sterility. Proc. Natl. Acad. Sci. U. S. A. 112, 14984–14989
Li, J. et al. (2017) Generation of thermosensitive male-sterile maize by targeted knockout of the ZmTMS5 gene. J. Genet. Genomics 44, 465–468
Li, Q. et al. (2016) Development of japonica photo-sensitive genic male sterile rice lines by editing Carbon Starved Anther using CRISPR/Cas9. J. Genet. Genomics 43, 415–419
Luo, D. et al. (2013) A detrimental mitochondrial–nuclear interaction causes cytoplasmic male sterility in rice. Nat. Genet. 45,573–577
Kim YJ, Zhang D. (2018) Molecular Control of Male Fertility for Crop Hybrid Breeding.Trends Plant Sci. Jan;23(1):53-65.
Tang H, et al. (2017) Multi-step formation, evolution, and functionalization of new cytoplasmic male sterility genes in the plant mitochondrial genomes. Cell Research, 27:130-146.
Xue Z et al. (2018) Deficiency of a triterpene pathway results in humidity-sensitive genic male sterility in rice. Nature Communications, doi:10.1038/s41467-018-03048-8
Yu, J. et al. (2017) Two rice receptor-like kinases maintain male fertility under changing temperatures. Proc Natl Acad Sci U S A. 114(46):12327-12332
Zhang, H. et al. (2013) Mutation in CSA creates a new photoperiod-sensitive genic male sterile line applicable for hybrid rice seed production. Proc. Natl. Acad. Sci. U. S. A. 110, 76–81
Zhou, H. et al. (2014) RNase Z(S1) processes UbL40 mRNAs and controls thermosensitive genic male sterility in rice. Nat. Commun. 5, 4884
Zhou, H. et al. (2016) Development of commercial thermos-sensitive genic male sterile rice accelerates hybrid rice breeding using the CRISPR/Cas9-mediated TMS5 editing system. Sci. Rep. 6,37395
邱龙,等(2012). 耐除草剂转基因作物研究现状及发展前景. 中国农业科学, 45(12):2357-2363
张启发.(2016) 杂交水稻的辉煌50年. 科学通报, 61(35):3730- 3731
